Трудно представить прогресс в какой бы то ни было области хозяйства без химии - в частности, без органической химии. Все сферы хозяйства связаны с современной химической наукой и технологией.
Органическая химия изучает вещества, содержащие в своем составе углерод, за исключением окиси углерода, углекислого газа и солей угольной кислоты (эти соединения по свойствам ближе к неорганическим соединениям).
Как наука органическая химия до середины XVIII века не существовала. К тому времени различали три вида химии: химию животных, растительную и минеральную. Химия животных изучала вещества, входящие в состав животных организмов; растительная - вещества, входящие в состав растений; минеральная - вещества, входящие в состав неживой природы. Этот принцип, однако, не позволял отделить органические вещества от неорганических. Например, янтарная кислота относилась к группе минеральных веществ, так как ее получали перегонкой ископаемого янтаря, поташ входил в группу растительных веществ, а фосфат кальция - в группу животных веществ, так как их получали прокаливанием соответственно растительных (древесина) и животных (кости) материалов.
В первой половине XIX века было предложено выделить соединения углерода в самостоятельную химическую дисциплину - органическую химию.
Среди ученых в то время господствовало виталистическое мировоззрение, согласно которому органические соединения образуются только в живом организме под влиянием особой, сверхъестественной "жизненной силы". Это означало, что получить органические вещества путем синтеза из неорганических невозможно, что между органическими и неорганическими соединениями лежит непреодолимая пропасть. Витализм настолько укрепился в умах ученых, что долгое время не предпринималось никаких попыток синтеза органических веществ. Однако витализм был опровергнут практикой, химическим экспериментом.
В 1828 г. немецкий химик Вёлер, работая с циановокислым аммонием, случайно получил мочевину
O
II
NH2-C-NH2.
В 1854 г. француз Бертло синтезировал вещества, относящиеся к жирам, а в 1861 г. русский ученый Бутлеров синтезировал вещества, относящиеся к классу сахаров. Это были тяжелые удары по виталистической теории, окончательно разбивающие убеждение о невозможности синтеза органических соединений.
Эти и другие достижения химиков требовали теоретического объяснения и обобщения возможных путей синтеза органических соединений и связи их свойств со строением.
Исторически первой теорией органической химии стала теория радикалов (Ж.Дюма, Ю.Либих, И.Берцелиус). По мнению авторов, многие превращения органических соединений протекают так, что некоторые группы атомов (радикалы), не изменяясь, переходят из одного органического соединения в другое. Однако, вскоре было установлено, что в органических радикалах атомы водорода могут замещаться даже на такие отличные от водорода по химической природе атомы, как атомы хлора, и при этом тип химического соединения сохраняется.
Теорию радикалов сменила более совершенная и охватывающая больший экспериментальный материал теория типов (О.Лоран, Ш.Жерар, Ж.Дюма). Теория типов классифицировала органические вещества по типам превращений. К типу водорода относили углеводороды, к типу хлороводорода - галогенопроизводные, к типу воды - спирты, эфиры, кислоты и их ангидриды, к типу аммиака - амины. Однако накапливающийся огромный экспериментальный материал уже не укладывался в известные типы и, кроме того, теория типов не могла предсказать существование и пути синтеза новых органических соединений. Развитие науки требовало создания новой, более прогрессивной теории, для рождения которой уже существовали некоторые предпосылки: установлена четырехвалентность углерода (А.Кекуле и А.Кольбе, 1857 год), показана способность атома углерода образовывать цепочки атомов (А.Кекуле и А.Купер, 1857 год).
Решающая роль в создании теории строения органических соединений принадлежит великому русскому ученому Александру Михайловичу Бутлерову. 19 сентября 1861 года на 36-м съезде немецких естествоиспытателей А.М.Бутлеров обнародовал ее в докладе "О химическом строении вещества".
Основные положения теории химического строения А.М.Бутлерова можно свести к следующему.
1. Все атомы в молекуле органического соединения связаны друг с другом в определенной последовательности в соответствии с их валентностью. Изменение последовательности расположения атомов приводит к образованию нового вещества с новыми свойствами. Например, составу вещества С2Н6О отвечают два разных соединения: диметиловый эфир (СН3-О-СН3) и этиловый спирт (С2Н5ОН).
2. Свойства веществ зависят от их химического строения. Химическое строение - это определенный порядок в чередовании атомов в молекуле, во взаимодействии и взаимном влиянии атомов друг на друга - как соседних, так и через другие атомы. В результате каждое вещество имеет свои особые физические и химические свойства. Например, диметиловый эфир - это газ без запаха, нерастворимый в воде, t°пл. = -138°C, t°кип. = 23,6°C; этиловый спирт - жидкость с запахом, растворимая в воде, t°пл. = -114,5°C, t°кип. = 78,3°C.
Данное положение теории строения органических веществ объяснило явление изомерии, широко распространенное в органической химии. Приведенная пара соединений - диметиловый эфир и этиловый спирт - один из примеров, иллюстрирующих явление изомерии.
3. Изучение свойств веществ позволяет определить их химическое строение, а химическое строение веществ определяет их физические и химические свойства.
4. Атомы углерода способны соединятся между собой, образовывая углеродные цепи различного вида. Они могут быть как открытыми, так и замкнутыми (циклическими), как прямыми, так и разветвленными. В зависимости от числа связей, затрачиваемых атомами углерода на соединение друг с другом, цепи могут быть насыщенными (с одинарными связями) или ненасыщенными (с двойными и тройными связями).
5. Каждое органическое соединение имеет одну определенную формулу строения или структурную формулу, которую строят, основываясь на положении о четырехвалентном углероде и способности его атомов образовывать цепи и циклы. Строение молекулы как реального объекта можно изучить экспериментально химическими и физическими методами.
А.М.Бутлеров не ограничился теоретическими объяснениями своей теории строения органических соединений. Он провел ряд экспериментов, подтвердив предсказания теории получением изобутана, трет. бутилового спирта и т.д. Это дало возможность А.М.Бутлерову заявить в 1864 году, что имеющиеся факты позволяют ручаться за возможность синтетического получения любого органического вещества.
В дальнейшем развитии и обосновании теории строения органических соединений большую роль сыграли последователи Бутлерова - В.В.Марковников, Е.Е.Вагнер, Н.Д.Зелинский, А.Н.Несмеянов и др.
Современный период развития органической химии в области теории характеризуется все возрастающим проникновением методов квантовой механики в органическую химию. С их помощью решаются вопросы о причинах тех или иных проявлений взаимного влияния атомов в молекулах. В области развития органического синтеза современный период характеризуется значительными успехами в получении многочисленных органических соединений, в число которых входят природные вещества - антибиотики, разнообразные лекарственные соединения, многочисленные высокомолекулярные соединения. Органическая химия глубоко проникла в сферу физиологии. Так, с химической точки зрения изучена гормональная функция организма, механизм передачи нервных импульсов. Ученые вплотную подошли к разрешению вопроса о строении и синтезе белка.
Органическая химия как самостоятельная наука продолжает существовать и интенсивно развиваться. Это объясняется следующими причинами:
1. Многообразием органических соединений, обусловленным тем, что углерод в отличие от других элементов способен соединяться друг с другом, давая длинные цепочки (изомеры). В настоящее время известно около 6 млн. органических соединений, в то время как неорганических - только около 700 тысяч.
2. Сложностью молекул органических веществ, содержащих до 10 тысяч атомов (например, природные биополимеры - белки, углеводы).
3. Специфичностью свойств органических соединений по сравнению с неорганическими (неустойчивостью при сравнительно невысоких температурах, низкой - до 300°С - температурой плавления, горючестью).
4. Медленно идущими реакциями между органическими веществами по сравнению с реакциями, характерными для неорганических веществ, образованием побочных продуктов, спецификой выделения получающихся веществ и технологическим оборудованием.
5. Огромным практическим значением органических соединений. Они - наша пища и одежда, топливо, разнообразные лекарственные препараты, многочисленные полимерные материалы и т.д.
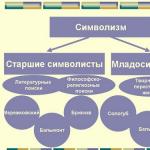
Классификация органических соединений
Огромное количество органических соединений классифицируют с учетом строения углеродной цепи (углеродного скелета) и наличия в молекуле функциональных групп.
На схеме представлена классификация органических соединений в зависимости от строения углеродной цепи.
Органические соединения
Ациклические (алифатические)
(соединения с открытой цепью)
Циклические
(соединения с замкнутой цепью)
Насыщенные (предельные)
Ненасыщенные (непредельные)
Карбоциклические (цикл состоит только из атомов углерода)
Гетероциклические (цикл состоит из атомов углерода и других элементов)
Алициклические (алифатические циклические)
Ароматические
Простейшими представителями ациклических соединений являются алифатические углеводороды - соединения, содержащие только атомы углерода и водорода. Алифатические углеводороды могут быть насыщенными (алканы) и ненасыщенными (алкены, алкадиены, алкины).
Простейшим представителем алициклических углеводородов служит циклопропан, содержащий цикл из трех углеродных атомов.
Ароматический ряд объединяет ароматические углеводороды - бензол, нафталин, антрацен и т.д., а также их производные.
Гетероциклические соединения могут содержать в цикле, кроме атомов углерода, один или несколько атомов других элементов - гетероатомов (кислород, азот, серу и др.).
В каждом представленном ряду органические соединения делятся на классы в зависимости от состава и строения. Наиболее простым классом органических соединений являются углеводороды. При замене атомов водорода в углеводородах на другие атомы или группы атомов (функциональные группы) образуются другие классы органических соединений данного ряда.
Функциональная группа - атом или группа атомов, устанавливающие принадлежность соединения к классам органических соединений и определяющие главнейшие направления его химических превращений.
Соединения с одной функциональной группой называются монофункциональными (метанол СН3-ОН), с несколькими одинаковыми функциональными группами - полифункциональными (глицерин
СН2-
I
OH СН-
I
OH СН2),
I
OH
с несколькими разными функциональными группами - гетерофункциональными (молочная кислота
СН3-
СН-СООН).
I
OH
Соединения каждого класса составляют гомологические ряды. Гомологический ряд - это бесконечный ряд органических соединений, имеющих сходное строение и, следовательно, сходные химические свойства и отличающихся друг от друга на любое число СН2- групп (гомологическая разность).
Основные классы органических соединений следующие:
I. Углеводороды (R-H).
II. Галогенопроизводные (R-Hlg).
III. Спирты (R-OH).
O
IV. Эфиры простые и сложные (R-O-R’, R-C).
\
OR’
O
V. Карбонильные соединения (альдегиды и кетоны) (R-C
\
H
O
II
, R-C-R).
O
VI. Карбоновые кислоты R-C).
\
OH
R
I
VII. Амины (R-NH2, NH, R-N-R’).
I I
R’ R’’
VIII. Нитросоединения (R-NO2).
IX. Сульфокислоты (R-SO3H).
Число известных классов органических соединений не ограничивается перечисленными, оно велико и с развитием науки все время увеличивается.
Все классы органических соединений взаимосвязаны. Переход от одних классов соединений к другим осуществляется в основном за счет превращений функциональных групп без изменения углеродного скелета.
Классификация реакций органических соединений по характеру химических превращений
Органические соединения способны к разнообразным химическим превращениям, которые могут проходить как без изменения углеродного скелета, так и с таковым. Большинство реакций проходит без изменения углеродного скелета.
I. Реакции без изменения углеродного скелета
К реакциям без изменения углеродного скелета относятся следующие:
1) замещения: RH + Br2 ® RBr + HBr,
2) присоединения: CH2=CH2 + Br2 ® CH2Br - CH2Br,
3) отщепления (элиминирования): CH3-CH2-Cl ® CH2=CH2 + HCl,
4) изомеризации: CH3-CH2-CєСH
------®
¬------
Реакции замещения характерны для всех классов органических соединений. Замещаться могут атомы водорода или атомы любого другого элемента, кроме углерода.
Реакции присоединения характерны для соединений с кратными связями, которые могут быть между атомами углерода, углерода и кислорода, углерода и азота и т. д., а также для соединений, содержащих атомы со свободными электронными парами или вакантными орбиталями.
К реакциям элиминирования способны соединения, содержащие электроотрицательные группировки. Легко отщепляются такие вещества, как вода, галогеноводороды, аммиак.
К реакциям изомеризации без изменения углеродного скелета особенно склонны непредельные соединения и их производные.
II. Реакции с изменением углеродного скелета
К этому типу превращений органических соединений относятся следующие реакции:
1) удлинения цепи,
2) укорачивания цепи,
3) изомеризации цепи,
4) циклизации,
5) раскрытия цикла,
6) сжатия и расширения цикла.
Химические реакции проходят с образованием различных промежуточных продуктов. Путь, по которому осуществляется переход от исходных веществ к конечным продуктам, называется механизмом реакции. В зависимости от механизма реакции они делятся на радикальные и ионные. Ковалентные связи между атомами А и В могут разрываться таким образом, что электронная пара или делится между атомами А и В, или передается одному из атомов. В первом случае частицы А и В, получив по одному электрону, становятся свободными радикалами. Происходит гомолитическое расщепление:
А: В ® А. + .В
Во втором случае электронная пара переходит к одной из частиц и образуются два разноименных иона. Поскольку образующиеся ионы имеют различные электронные структуры, этот тип разрыва связи называется гетеролитическим расщеплением:
А: В ® А+ + :В-
Положительный ион в реакциях будет стремиться присоединить к себе электрон, т. е. будет вести себя как электрофильная частица. Отрицательный ион - так называемая, нуклеофильная частица будет атаковать центры с избыточными положительными зарядами.
Изучение условий и методов проведения, а также механизмов реакций органических соединений составляет основное содержание данного курса органической химии.
Вопросы номенклатуры органических соединений, как правило, излагаются во всех учебниках органической химии, поэтому мы сознательно опускаем рассмотрение этого материала, обращая внимание на то, что во всех случаях написания уравнений реакций исходные и образующиеся соединения снабжаются соответствующими названиями. Эти названия со знанием основ номенклатуры позволят каждому самостоятельно решить вопросы, связанные с номенклатурой органических соединений.
Изучение органической химии начинают по обыкновению с алифатического ряда и с наиболее простого класса веществ - углеводородов.
Органическая химия – наука, изучающая соединения углерода, называемые органическими веществами. В связи с этим органическую химию называют также химией соединений углерода.
Важнейшие причины выделения органической химии в отдельную науку заключаются в следующем.
1.Многочисленность органических соединений по сравнению с неорганическими.
Число известных органических соединений (около 6 млн.) значительно превышает число соединений всех остальных элементов периодической системы Менделеева. В настоящее время известно около 700 тыс. неорганических соединений, примерно 150 тыс. новых органических соединений получают сейчас в один год. Это объясняется не только тем, что химики особенно интенсивно занимаются синтезом и исследованием органических соединений, но и особой способностью элемента углерода давать соединения, содержащие практически неограниченное число атомов углерода, связанных в цепи и циклы.
2. Органические вещества имеют исключительное значение как вследствие их крайне многообразного практического применения, так и потому, что они играют важнейшую роль в процессах жизнедеятельности организмов.
3. Имеются существенные отличия в свойствах и реакционной способности органических соединений от неорганических , вследствие чего возникла необходимость в развитии многих специфических методов исследования органических соединений.
Предметом органической химии является изучение способов получения, состава, строения и областей применения важнейших классов органических соединений.
2. Краткий исторический обзор развития органической химии
Органическая химия как наука оформилась в начале XIX в., однако знакомство человека с органическими веществами и применение их для практических целей началось еще в глубокой древности. Первой известной кислотой был уксус, или водный раствор уксусной кислоты. Древним народам было известно брожение виноградного сока, они знали примитивный способ перегонки и применяли его для получения скипидара; галлы и германцы знали способы варки мыла; в Египте, Галлии и Германии умели варить пиво.
В Индии, Финикии и Египте было весьма развито искусство крашения при помощи органических веществ. Кроме того, древние народы пользовались такими органическими веществами, как масла, жиры, сахар, крахмал, камедь, смолы, индиго и т. д.
Период развития химических знаний в средние века (приблизительно до XVI в.) получил название периода алхимии. Однако изучение неорганических веществ было значительно более успешным, чем изучение веществ органических. Сведения о последних остались почти столь же ограниченными, как и в более древние века. Некоторый шаг вперед был сделан благодаря совершенствованию методов перегонки. Таким путем, в частности, было выделено несколько эфирных масел и получен крепкий винный спирт, считавшийся одним из веществ, с помощью которых можно приготовить философский камень.
Конец XVIII в. ознаменовался заметными успехами в изучении органических веществ, причем органические вещества начали исследовать с чисто научной точки зрения. В этот период был выделен из растений и описан ряд важнейших органических кислот (щавелевая, лимонная, яблочная, галловая) и установлено, что масла и жиры содержат в качестве общей составной части «сладкое начало масел» (глицерин) и т. д.
Постепенно начали развиваться исследования органических веществ - продуктов жизнедеятельности животных организмов. Так, например, из мочи человека были выделены мочевина и мочевая кислота, а из мочи коровы и лошади - гиппуровая кислота.
Накопление значительного фактического материала явилось сильным толчком к более глубокому изучению органического вещества.
Впервые понятия об органических веществах и об органической химии ввел шведский ученый Берцелиус (1827). В учебнике химии, выдержавшем много изданий, Берцелиус высказывает убеждение, что «в живой природе элементы повинуются иным законам, чем в безжизненной» и что органические вещества не могут образовываться под влиянием обычных физических и химических сил, но требуют для своего образования особой «жизненной силы». Органическую химию он и определял как «химию растительных и животных веществ, или веществ, образующихся под влиянием жизненной силы». Последующее развитие органической химии доказало ошибочность этих взглядов.
В 1828 г. Вёлер показал, что неорганическое вещество - циановокислый аммоний - при нагревании превращается в продукт жизнедеятельности животного организма - мочевину.
В 1845 г. Кольбе синтезировал типичное органическое вещество - уксусную кислоту, использовав в качестве исходных веществ древесный уголь, серу, хлор и воду. За сравнительно короткий период был синтезирован ряд других органических кислот, которые до этого выделялись только из растений.
В 1854 г. Бертло удалось синтезировать вещества, относящиеся к классу жиров.
В 1861 г. А. М, Бутлеров действием известковой воды на параформальдегид впервые осуществил синтез метиленитана - вещества, относящегося к классу Сахаров, которые, как известно, играют важную роль в процессах жизнедеятельности организмов.
Все эти научные открытия привели к краху витализма - идеалистического учения о «жизненной силе».
Из всего многообразия химических соединений большая часть (свыше четырех миллионов) содержит углерод. Почти все они относятся к органическим веществам. Органические соединения встречаются в природе, например углеводы, белки, витамины, они играют важную роль в жизнедеятельности животных и растений. Многие органическиё вещества и их смеси (пластмассы, каучук, нефть, природный газ и другие) имеют большое значение для развития народного хозяйства страны.
Химия соединений углерода называется органической химией. Так определил предмет органической химии великий русский химик-органик А.М. Бутлеров. Однако не все соединения углерода принято относить к органическим. Такие простейшие вещества, как оксид углерода (II) СО, диоксид углерода СО2, угольная кислота Н2СО3 и ее соли, например, СаСО3, К2СО3, относят к неорганическим соединениям. В состав органических веществ кроме углерода могут входить и другие элементы. Наиболее часто - это водород, галогены, кислород, азот, сера и фосфор. Существуют также органическиё, вещества, содержащие другие элементы, в том числе металлы.
2. Строение атома углерода (С), структура его электронной оболочки
2.1 Значение атома углерода (С) в химическом строении органических соединений
УГЛЕРОД (лат. Carboneum), С, химический элемент подгруппы IVa периодической системы; атомный номер 6, атомная масса 12,0107, относится к неметаллам. Природный углерод состоит из двух стабильных нук лидов - 12С (98,892% по массе) и 13С (1,108%) и одного нестабильного - С с периодом полураспада 5730 лет.
Распространённость в природе. На долю углерода приходится 0,48% от массы земной коры, в которой он по содержанию занимает среди других элементов 17-е место. Основные углерод-содержащие породы - природные карбонаты (известняки и доломиты); количество углерода в них составляет около 9,610 т.
В свободном состоянии углерод встречается в природе в виде горючих ископаемых, а также в виде минералов - алмаза и графита. Около 1013 т углерода сосредоточено в таких горючих ископаемых, как каменный и бурый уголь, торф, сланцы, битумы, образующих мощные скопления в недрах Земли, а также в природных горючих газах. Алмазы чрезвычайно редки. Даже алмазоносные породы (кимберлиты) содержат не более 9-10 % алмазов массой, как правило, не более 0,4 г. Найденным крупным алмазам обычно присваивают особое название. Самый большой алмаз «Куллинан» весом 621,2 г (3106 карат) был найден в Южной Африке (Трансвааль) в 1905 г., а самый большой русский алмаз «Орлов» весом 37,92 г (190 карат) -в Сибири в середине 17 в.
Чёрно-серый непрозрачный жирный на ощупь с металлическим блеском графит представляет собой скопление плоских полимерных молекул из атомов углерода, непрочно наслоённых друг на друга. При этом атомы внутри слоя связаны между собой сильнее, чем атомы между слоями.
Другое дело алмаз. В его бесцветном, прозрачном и сильно преломляющем свет кристалле каждый атом углерода связан химическими связями с четырьмя такими же атомами, расположенными в вершинах тетраэдра. Все связи одинаковы по длине и очень прочны. Они образуют в пространстве непрерывный трёхмерный каркас. Весь кристалл алмаза представляет собой как бы одну гигантскую полимерную молекулу, не имеющую «слабых» мест, т.к. прочность всех связей одинакова.
Плотность алмаза при 20°С равна 3,51 г/см 3 , графита - 2,26 г/см 3 . Физические свойства алмаза (твёрдость, электропроводность, коэффициент термического расширения) практически одинаковы по всем направлениям; он является самым твёрдым из всех найденных в природе веществ. В графите же эти свойства по разным направлениям - перпендикулярному или параллельному слоям атомов углерода - сильно различаются: при небольших боковых усилиях параллельные слои графита сдвигаются друг относительно друга и он расслаивается на отдельные чешуйки, оставляющие след на бумаге. По электрическим свойствам алмаз - диэлектрик, графит же проводит электрический ток.
Алмаз при нагревании без доступа воздуха выше 1000 °С превращается в графит. Графит при постоянном нагревании в тех же условиях не изменяется вплоть до 3000°С, когда он возгоняется без плавления. Прямой переход графита в алмаз происходит только при температуре выше 3000°С и огромном давлении - около 12 ГПа.
Третья аллотропная модификация углерода -карбин - получена искусственно. Это мелкокристаллический чёрный порошок; в его структуре длинные цепочки атомов углерода расположены параллельно друг другу. Каждая цепочка имеет строение (-С=С) Л или (=С=С=) Л. Плотность карбина средняя между графитом и алмазом -2,68-3,30 г/см 3 . Одна из важнейших особенностей карбина - его совместимость с тканями человеческого организма, что позволяет применять его, например, при изготовлении не-отторгаемых организмом искусственных кровеносных сосудов (рис. 1).
Название своё фуллерены получили не в честь химика, а по имени американского архитектора Р. Фуллера, который предложил строить ангары и другие сооружения в виде куполов, поверхность которых образуют пяти- и шестиугольники (такой купол построен, например, московском парке «Сокольники»).
Для углерода характерно также состояние с неупорядоченной структурой - это т. наз. аморфный углерод (сажа, кокс, древесный уголь) рис. 2. Получение углерода (С):

Большинство окружающих нас веществ - органические соединения. Это ткани животных и растений, наша пища, лекарства, одежда (хлопчатобумажные, шерстяные и синтетические волокна), топливо (нефть и природный газ), резина и пластмассы, моющие средства. В настоящее время известно более 10 миллионов таких веществ, и число их каждый год значительно возрастает благодаря тому, что учёные выделяют неизвестные вещества из природных объектов и создают новые, не существующие в природе соединения.
Такое многообразие органических соединений связано с уникальной особенностью атомов углерода образовывать прочные ковалентные связи, как между собой, так и с другими атомами. Атомы углерода, соединяясь друг с другом как простыми, так и кратными связями, могут образовывать цепочки практически любой длины и циклы. Большое разнообразие органических соединений связано также с существованием явления изомерии.
Почти все органические соединения содержат также водород, часто в их состав входят атомы кислорода, азота, реже - серы, фосфора, галогенов. Соединения, содержащие атомы любых элементов (за исключением О, N, S и галогенов), непосредственно связанные с углеродом, объединены под названием элементоорганические соединения; основную группу таких соединений составляют металлоорганические соединения (рис. 3).

Огромное число органических соединений требует их четкой классификации. Основу органического соединения составляет скелет молекулы. Скелет может иметь открытую (незамкнутую) структуру, тогда соединение называют ациклическим (алифатическим; алифатические соединения называют также соединениями жирного ряда, т.к. они впервые были выделены из жиров), и замкнутую структуру, тогда его называют циклическим. Скелет может быть углеродным (состоять только из атомов углерода) либо содержать другие, отличные от углерода атомы - т. наз. гетероатомы, чаще всего кислород, азот и серу. Циклические соединения подразделяют на карбоцикличе-ские (углеродные), которые могут быть ароматическими и алициклическими (содержащими один или несколько циклов), и гетероциклические.
Атомы водорода и галогенов в скелет не входят, а гетероатомы входят в скелет лишь в том случае, если они имеют, по меньшей мере, две связи с углеродом. Так, в этиловом спирте СН3СН2ОН атом кислорода не включён в скелет молекулы, а в диметиловом эфире СН3ОСН3 включён в него.
Кроме того, ациклический скелет может быть неразветвлённым (все атомы расположены в один ряд) и разветвлённым. Иногда неразветвлённый скелет называют линейным, однако следует помнить, что структурные формулы, которыми мы чаще всего пользуемся, передают лишь порядок связи, а не реальное расположение атомов. Так, «линейная» углеродная цепь имеет зигзагообразную форму и может закручиваться в пространстве различными способами.
В скелете молекулы различают четыре типа атомов углерода. Принято атом углерода называть первичным, если он образует только одну связь с другим атомом углерода. Вторичный атом связан с двумя другими атомами углерода, третичный - с тремя, а четвертичный все свои четыре связи затрачивает на образование связей с атомами углерода.
Следующим классификационным признаком является наличие кратных связей. Органические соединения, содержащие только простые связи, называются насыщенными (предельными). Соединения, содержащие двойные или тройные связи, называются ненасыщенными (непредельными). В их молекулах на один атом углерода приходится меньшее число атомов водорода, чем в предельных. Циклические ненасыщенные углеводороды ряда бензола выделяют в отдельный класс ароматических соединений.
Третьим классификационным признаком является наличие функциональных групп-групп атомов, характерных для данного класса соединений и определяющих его химические свойства. По количеству функциональных групп органические соединения делятся на монофункциональные - содержат одну функциональную группу, полифункциональные - содержат несколько функциональных групп, например глицерин, и гетерофунк-циональные - в одной молекуле несколько различных групп, например аминокислоты.
В зависимости от того, у какого атома углерода находится функциональная группа, соединения делятся на первичные, например этилхлорид СН 3 СН 2 С1, вторичные - изопропилхлорид (СНз)2СНС1 и третичные - бутилхлорид (СН 8) 8 ССl.
В прошлом ученые разделяли все вещества в природе на условно неживые и живые, включая в число последних царство животных и растений. Вещества первой группы получили название минеральных. А те, что вошли во вторую, стали называть органическими веществами.
Что под этим подразумевается? Класс органических веществ наиболее обширный среди всех химических соединений, известных современным ученым. На вопрос, какие вещества органические, можно ответить так – это химические соединения, в состав которых входит углерод.
Обратите внимание, что не все углеродсодержащие соединения относятся к органическим. Например, корбиды и карбонаты, угольная кислота и цианиды, оксиды углерода не входят в их число.
Почему органических веществ так много?
Ответ на этот вопрос кроется в свойствах углерода. Этот элемент любопытен тем, что способен образовывать цепочки из своих атомов. И при этом углеродная связь очень стабильная.
Кроме того, в органических соединениях он проявляет высокую валентность (IV), т.е. способность образовывать химические связи с другими веществами. И не только одинарные, но также двойные и даже тройные (иначе – кратные). По мере возрастания кратности связи цепочка атомов становится короче, а стабильность связи повышается.
А еще углерод наделен способностью образовывать линейные, плоские и объемные структуры.
Именно поэтому органические вещества в природе так разнообразны. Вы легко проверите это сами: встаньте перед зеркалом и внимательно посмотрите на свое отражение. Каждый из нас – ходячее пособие по органической химии. Вдумайтесь: не меньше 30% массы каждой вашей клетки – это органические соединения. Белки, которые построили ваше тело. Углеводы, которые служат «топливом» и источником энергии. Жиры, которые хранят запасы энергии. Гормоны, которые управляют работой органов и даже вашим поведением. Ферменты, запускающие химические реакции внутри вас. И даже «исходный код», цепочки ДНК – все это органические соединения на основе углерода.
Состав органических веществ
Как мы уже говорили в самом начале, основной строительный материал для органических веществ – это углерод. И практические любые элементы, соединяясь с углеродом, могут образовывать органические соединения.
В природе чаще всего в составе органических веществ присутствуют водород, кислород, азот, сера и фосфор.
Строение органических веществ
Многообразие органических веществ на планете и разнообразие их строения можно объяснить характерными особенностями атомов углерода.
Вы помните, что атомы углерода способны образовывать очень прочные связи друг с другом, соединяясь в цепочки. В результате получаются устойчивые молекулы. То, как именно атомы углерода соединяются в цепь (располагаются зигзагом), является одной из ключевых особенностей ее строения. Углерод может объединяться как в открытые цепи, так и в замкнутые (циклические) цепочки.
Важно и то, что строение химических веществ прямо влияет на их химические свойства. Значительную роль играет и то, как атомы и группы атомов в молекуле влияют друг на друга.
Благодаря особенностям строения, счет однотипным соединениям углерода идет на десятки и сотни. Для примера можно рассмотреть водородные соединения углерода: метан, этан, пропан, бутан и т.п.
Например, метан – СН 4 . Такое соединение водорода с углеродом в нормальных условиях пребывает в газообразном агрегатном состоянии. Когда же в составе появляется кислород, образуется жидкость – метиловый спирт СН 3 ОН.
Не только вещества с разным качественным составом (как в примере выше) проявляют разные свойства, но и вещества одинакового качественного состава тоже на такое способны. Примером могут служить различная способность метана СН 4 и этилена С 2 Н 4 реагировать с бромом и хлором. Метан способен на такие реакции только при нагревании или под ультрафиолетом. А этилен реагирует даже без освещения и нагревания.
Рассмотрим и такой вариант: качественный состав химических соединений одинаков, количественный – отличается. Тогда и химические свойства соединений различны. Как в случае с ацетиленом С 2 Н 2 и бензолом С 6 Н 6 .
Не последнюю роль в этом многообразии играют такие свойства органических веществ, «завязанные» на их строении, как изомерия и гомология.
Представьте, что у вас есть два на первый взгляд идентичных вещества – одинаковый состав и одна и та же молекулярная формула, чтобы описать их. Но строение этих веществ принципиально различно, откуда вытекает и различие химических и физических свойств. К примеру, молекулярной формулой С 4 Н 10 можно записать два различных вещества: бутан и изобутан.

Речь идет об изомерах – соединениях, которые имеют одинаковый состав и молекулярную массу. Но атомы в их молекулах расположены в различном порядке (разветвленное и неразветвленное строение).
Что касается гомологии – это характеристика такой углеродной цепи, в которой каждый следующий член может быть получен прибавлением к предыдущему одной группы СН 2 . Каждый гомологический ряд можно выразить одной общей формулой. А зная формулу, несложно определить состав любого из членов ряда. Например, гомологи метана описываются формулой C n H 2n+2 .
По мере прибавления «гомологической разницы» СН 2 , усиливается связь между атомами вещества. Возьмем гомологический ряд метана: четыре первых его члена – газы (метан, этан, пропан, бутан), следующие шесть – жидкости (пентан, гексан, гептан, октан, нонан, декан), а дальше следуют вещества в твердом агрегатном состоянии (пентадекан, эйкозан и т.д.). И чем прочнее связь между атомами углерода, тем выше молекулярный вес, температуры кипения и плавления веществ.
Какие классы органических веществ существуют?
К органическим веществам биологического происхождения относятся:
- белки;
- углеводы;
- нуклеиновые кислоты;
- липиды.
Три первых пункта можно еще назвать биологическими полимерами.
Более подробная классификация органических химических веществ охватывает вещества не только биологического происхождения.
К углеводородам относятся:
- ациклические соединения:
- предельные углеводороды (алканы);
- непредельные углеводороды:
- алкены;
- алкины;
- алкадиены.
- циклические соединения:
- соединения карбоциклические:
- алициклические;
- ароматические.
- соединения гетероциклические.
- соединения карбоциклические:
Есть также иные классы органических соединений, в составе которых углерод соединяется с другими веществами, кроме водорода:
- спирты и фенолы;
- альдегиды и кетоны;
- карбоновые кислоты;
- сложные эфиры;
- липиды;
- углеводы:
- моносахариды;
- олигосахариды;
- полисахариды.
- мукополисахариды.
- амины;
- аминокислоты;
- белки;
- нуклеиновые кислоты.
Формулы органических веществ по классам

Примеры органических веществ
Как вы помните, в человеческом организме различного рода органические вещества – основа основ. Это наши ткани и жидкости, гормоны и пигменты, ферменты и АТФ, а также многое другое.
В телах людей и животных приоритет за белками и жирами (половина сухой массы клетки животных это белки). У растений (примерно 80% сухой массы клетки) – за углеводами, в первую очередь сложными – полисахаридами. В том числе за целлюлозой (без которой не было бы бумаги), крахмалом.
Давайте поговорим про некоторые из них подробнее.
Например, про углеводы . Если бы можно было взять и измерить массы всех органических веществ на планете, именно углеводы победили бы в этом соревновании.
Они служат в организме источником энергии, являются строительными материалами для клеток, а также осуществляют запас веществ. Растениям для этой цели служит крахмал, животным – гликоген.
Кроме того, углеводы очень разнообразны. Например, простые углеводы. Самые распространенные в природе моносахариды – это пентозы (в том числе входящая в состав ДНК дезоксирибоза) и гексозы (хорошо знакомая вам глюкоза).
Как из кирпичиков, на большой стройке природы выстраиваются из тысяч и тысяч моносахаридов полисахариды. Без них, точнее, без целлюлозы, крахмала, не было бы растений. Да и животным без гликогена, лактозы и хитина пришлось бы трудно.
Посмотрим внимательно и на белки . Природа самый великий мастер мозаик и пазлов: всего из 20 аминокислот в человеческом организме образуется 5 миллионов типов белков. На белках тоже лежит немало жизненно важных функций. Например, строительство, регуляция процессов в организме, свертывание крови (для этого существуют отдельные белки), движение, транспорт некоторых веществ в организме, они также являются источником энергии, в виде ферментов выступают катализатором реакций, обеспечивают защиту. В деле защиты организма от негативных внешних воздействий важную роль играют антитела. И если в тонкой настройке организма происходит разлад, антитела вместо уничтожения внешних врагов могут выступать агрессорами к собственным органам и тканям организма.

Белки также делятся на простые (протеины) и сложные (протеиды). И обладают присущими только им свойствами: денатурацией (разрушением, которое вы не раз замечали, когда варили яйцо вкрутую) и ренатурацией (это свойство нашло широкое применение в изготовлении антибиотиков, пищевых концентратов и др.).
Не обойдем вниманием и липиды (жиры). В нашем организме они служат запасным источником энергии. В качестве растворителей помогают протеканию биохимических реакций. Участвуют в строительстве организма – например, в формировании клеточных мембран.
И еще пару слов о таких любопытных органических соединениях, как гормоны . Они участвуют в биохимических реакциях и обмене веществ. Такие маленькие, гормоны делают мужчин мужчинами (тестостерон) и женщин женщинами (эстроген). Заставляют нас радоваться или печалиться (не последнюю роль в перепадах настроения играют гормоны щитовидной железы, а эндорфин дарит ощущение счастья). И даже определяют, «совы» мы или «жаворонки». Готовы вы учиться допоздна или предпочитаете встать пораньше и сделать домашнюю работу перед школой, решает не только ваш распорядок дня, но и некоторые гормоны надпочечников.
Заключение
Мир органических веществ по-настоящему удивительный. Достаточно углубиться в его изучение лишь немного, чтобы у вас захватило дух от ощущения родства со всем живым на Земле. Две ноги, четыре или корни вместо ног – всех нас объединяет волшебство химической лаборатории матушки-природы. Оно заставляет атомы углерода объединяться в цепочки, вступать в реакции и создавать тысячи таких разнообразных химических соединений.
Теперь у вас есть краткий путеводитель по органической химии. Конечно, здесь представлена далеко не вся возможная информация. Какие-то моменты вам, быть может, придется уточнить самостоятельно. Но вы всегда можете использовать намеченный нами маршрут для своих самостоятельных изысканий.
Вы также можете использовать приведенное в статье определение органического вещества, классификацию и общие формулы органических соединений и общие сведения о них, чтобы подготовиться к урокам химии в школе.
Расскажите нам в комментариях, какой раздел химии (органическая или неорганическая) нравится вам больше и почему. Не забудьте «расшарить» статью в социальных сетях, чтобы ваши одноклассники тоже смогли ею воспользоваться.
Пожалуйста, сообщите, если обнаружите в статье какую-то неточность или ошибку. Все мы люди и все мы иногда ошибаемся.
сайт, при полном или частичном копировании материала ссылка на первоисточник обязательна.
Алканы (предельные углеводороды, парафины) – ациклические насыщенные углеводороды общей формулы С n H 2n+2 . В соответствии с общей формулой алканы образуют гомологический ряд.
Первые четыре представителя имеют полусистематические названия – метан (CH 4), этан (С 2 Н 6), пропан (С 3 Н 8), бутан (С 4 Н 10). Названия последующих членов ряда строятся из корня (греческие числительные) и суффикса -ан : пентан (С 5 Н 12), гексан (С 6 Н 14), гептан (С 7 Н 16) и т. д.
Атомы углерода в алканах находятся в sp 3 -гибридном состоянии. Оси четырех sp 3 - орбиталей направлены к вершинам тетраэдра, валентные углы равны 109°28 .
Пространственное строение метана:
Энергия С-С связи Е с - с = 351 кДж/моль, длина С-С связи 0,154 нм.
Связь С-С в алканах является ковалентной неполярной. Связь С-Н – ковалентная слабополярная.
Для алканов, начиная с бутана, существуют структурные изомеры (изомеры строения), различающиеся порядком связывания между атомами углерода, с одинаковым качественным и количественным составом и молекулярной массой, но различающихся по физическим свойствам.
 Способы получения алканов
Способы получения алканов
1. С n H 2n+2 >400–700 °C > С p H 2p+2 + С m H 2m ,
Крекинг нефти (промышленный способ). Алканы также выделяют из природных источников (природный и попутный газы, нефть, каменный уголь).

(гидрирование непредельных соединений)
3. nCO + (2n + 1)Н 2 > С n H 2n+2 + nH 2 O (получение из синтез-газа (CO + Н 2))
4. (реакция Вюрца)

5. (реакция Дюма) CH 3 COONa + NaOH >t > CH 4 + Na 2 CO 3
6. (реакция Кольбе)
 Химические свойства алканов
Химические свойства алканов
Алканы не способны к реакциям присоединения, т. к. в их молекулах все связи насыщены, для них характерны реакции радикального замещения, термического разложения, окисления, изомеризации.
1. (реакционная способность убывает в ряду: F 2 > Cl 2 > Br 2 > (I 2 не идет), R 3 C > R 2 CH > RCH 2 > RCH 3 )

2. (реакция Коновалова)

3. C n H 2n+2 + SO 2 + ?O 2 >h? > C n H 2n+1 SO 3 H – алкилсульфокислота
(сульфоокисление, условия реакции: облучение УФ)
4. CH 4 >1000 °C > С + 2Н 2 ; 2CH 4 >t>1500 °C > С 2 Н 2 + ЗН 2 (разложение метана – пиролиз)
5. CH 4 + 2Н 2 O >Ni, 1300 °C > CO 2 + 4Н 2 (конверсия метана)
6. 2С n H 2n+2 + (Зn+1)O 2 > 2nCO 2 + (2n+2)Н 2 O (горение алканов)
7. 2н- С 4 Н 10 + 5O 2 > 4CH 3 COOH + 2Н 2 O (окисление алканов в промышленности; получение уксусной кислоты)
8. н- С 4 Н 10 > изо- С 4 Н 10 (изомеризация, катализатор AlCl 3)
2. Циклоалканы
Циклоалканы (циклопарафины, нафтены, цикланы, полиметилены) – предельные углеводороды с замкнутой (циклической) углеродной цепью. Общая формула С n H 2n .
Атомы углерода в циклоалканах, как и в алканах, находятся в sp 3 -гибридизованном состоянии. Гомологический ряд циклоалканов начинает простейший циклоалкан – циклопропан С 3 Н 6 , представляющий собой плоский трехчленный карбоцикл. По правилам международной номенклатуры в циклоалканах главной считается цепь углеродных атомов, образующих цикл. Название строится по названию этой замкнутой цепи с добавлением приставки «цикло» (циклопропан, циклобутан, циклопентан, циклогексан и т. д.).


Структурная изомерия циклоалканов связана с различной величиной цикла (структуры 1 и 2), строением и видом заместителей (структуры 5 и 6) и их взаимным расположением (структуры 3 и 4).
 Способы получения циклоалканов
Способы получения циклоалканов
1. Получение из дигалогенопроизводных углеводородов

2. Получение из ароматичесих углеводородов

 Химические свойства циклоалканов
Химические свойства циклоалканов
Химические свойства циклоалканов зависят от размера цикла, определяющего его устойчивость. Трех– и четырехчленные циклы (малые циклы), являясь насыщенными, резко отличаются от всех остальных предельных углеводородов. Циклопропан, циклобутан вступают в реакции присоединения. Для циклоалканов (С 5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т. е. реакции замещения.
1. Действие галогенов

2. Действие галогеноводородов
С циклоалканами, содержащими пять и более атомов углерода в цикле, галогеново-дороды не взаимодействуют.

4. Дегидрирование

Алкены (непредельные углеводороды, этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов С n Н 2n .
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса – ан на – ен : этан (CH 3 -CH 3) – этен (CH 2 =CH 2) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь. Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи.
В молекуле алкена ненасыщенные атомы углерода находятся в sp 2 -гибридизации, а двойная связь между ними образована?– и?-связью. sp 2 -Гибридные орбитали направлены друг к другу под углом 120°, и одна негибридизованная 2р -орбиталь, расположена под углом 90° к плоскости гибридных атомных орбиталей.
Пространственное строение этилена:

Длина связи С=С 0,134 нм, энергия связи С=С Е с=с = 611 кДж/моль, энергия?-связи Е? = 260 кДж/моль.
Виды изомерии: а) изомерия цепи; б) изомерия положения двойной связи; в) Z, Е (cis, trans ) – изомерия, вид пространственной изомерии.
Способы получения алкенов1. CH 3 -CH 3 >Ni, t > CH 2 =CH 2 + H 2 (дегидрирование алканов)
2. С 2 Н 5 OH >H,SO 4 , 170 °C> CH 2 =CH 2 + Н 2 O (дегидратация спиртов)
3. (дегидрогалогенирование алкилгалогенидов по правилу Зайцева)

4. CH 2 Cl-CH 2 Cl + Zn > ZnCl 2 + CH 2 =CH 2 (дегалогенирование дигалогенопроизводных)
5. HC?CH + Н 2 >Ni, t > CH 2 =CH 2 (восстановление алкинов)
Химические свойства алкеновДля алкенов наиболее характерны реакции присоединения, они легко окисляются и полимеризуются.
1. CH 2 =CH 2 + Br 2 > CH 2 Br-CH 2 Br
(присоединение галогенов, качественная реакция)
2. (присоединение галогеноводородов по правилу Марковникова)
3. CH 2 =CH 2 + Н 2 >Ni, t > CH 3 -CH 3 (гидрирование)
4. CH 2 =CH 2 + Н 2 O >H + > CH 3 CH 2 OH (гидратация)
5. ЗCH 2 =CH 2 + 2КMnO 4 + 4Н 2 O > ЗCH 2 OH-CH 2 OH + 2MnO 2 v + 2KOH (мягкое окисление, качественная реакция)
6. CH 2 =CH-CH 2 -CH 3 + КMnO 4 >H + > CO 2 + С 2 Н 5 COOH (жесткое окисление)
7. CH 2 =CH-CH 2 -CH 3 + O 3 > Н 2 С=O + CH 3 CH 2 CH=O формальдегид+пропаналь > (озонолиз)
8. С 2 Н 4 + 3O 2 > 2CO 2 + 2Н 2 O (реакция горения)
9. (полимеризация)

10. CH 3 -CH=CH 2 + HBr >перекись > CH 3 -CH 2 -CH 2 Br (присоединение бро-моводорода против правила Марковникова)
11. (реакция замещения в?-положение)

Алкины (ацетиленовые углеводороды) – ненасыщенные углеводороды, имеющие в своем составе тройную С?С связь. Общая формула алкинов с одной тройной связью С n Н 2n-2 . Простейший представитель ряда алкинов CH?CH имеет тривиальное название ацетилен. По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на -ин : этан (CH 3 -CH 3) – этин (CH?CH) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь. Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи.
В образовании тройной связи участвуют атомы углерода в sp -гибридизованном состоянии. Каждый из них имеет по две sp- гибридных орбитали, направленных друг к другу под углом 180°, и две негибридных p -орбитали, расположенных под углом 90° по отношению друг к другу и к sp -гибридным орбиталям.
Пространственное строение ацетилена:

Виды изомерии: 1) изомерия положения тройной связи; 2) изомерия углеродного скелета; 3) межклассовая изомерия с алкадиенами и циклоалкенами.
Способы получения алкинов1. СаО + ЗС >t > СаС 2 + CO;
СаС 2 + 2Н 2 O > Са(OH) 2 + CH?CH (получение ацетилена)
2. 2CH 4 >t>1500 °C > HC = CH + ЗН 2 (крекинг углеводородов)
3. CH 3 -CHCl 2 + 2KOH >в спирте > HC?CH + 2KCl + Н 2 O (дегалогенирова-ние)
CH 2 Cl-CH 2 Cl + 2KOH >в спирте > HC?CH + 2KCl + Н 2 O
Химические свойства алкиновДля алкинов характерны реакции присоединения, замещения. Алкины полиме-ризуются, изомеризуются, вступают в реакции конденсации.
1. (гидрирование)
2. HC?CH + Br 2 > CHBr=CHBr;
CHBr=CHBr + Br 2 > CHBr 2 -CHBr 2 (присоединение галогенов, качественная реакция)
3. CH 3 -С?CH + HBr > CH 3 -CBr=CH 2 ;
CH 3 -CBr=CH 2 + HBr > CH 3 -CBr 2 -CHg (присоединение галогеноводородов по правилу Марковникова)
4. (гидратация алинов, реация Кучерова)


5.(присоединение спиртов)
6.(присоединение карбоновых ислот)

7. CH?CH + 2Ag 2 O >NH 3 > AgC?CAgv + H 2 O (образование ацетиленидов, качественная реакция на концевую тройную связь)
8. CH?CH + [О] >КMnO 4 > HOOC-COOH > HCOOH + CO 2 (окисление)
9. CH?CH + CH?CH > CH 2 =CH-С?CH (катализатор – CuCl и NH 4 Cl, димеризация)
10. 3HC?CH >C, 600 °C > С 6 Н 6 (бензол) (циклоолигомеризация, реакция Зелинского)
5. Диеновые углеводороды
Алкадиены (диены) – непредельные углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов С n Н 2n _ 2 . Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах.
Способы получения диенов1. (метод СВ. Лебедева)

2. (дегидратация)

3. (дегидрирование)
 Химические свойства диенов
Химические свойства диенов
Для сопряженных диенов характерны реакции присоединения. Сопряженные диены способны присоединять не только по двойным связям (к C 1 и С 2 , С 3 и С 4), но и к концевым (С 1 и С 4) атомам углерода с образованием двойной связи между С 2 и С 3 .


6. Ароматические углеводороды
Арены, или ароматические углеводороды, – циклические соединения, молекулы которых содержат устойчивые циклические группы атомов с замкнутой системой сопряженных связей, объединяемые понятием ароматичности, которая обуславливает общие признаки в строении и химических свойствах.
Все связи С-С в бензоле равноценны, их длина равна 0,140 нм. Это означает, что в молекуле бензола между углеродными атомами нет чисто простых и двойных связей (как в формуле, предложенной в 1865 г. немецким химиком Ф. Кекуле), а все они выровнены (дел окал изованы).
 формула Кекуле
формула Кекуле
Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R): С 6 Н 5 -R, R-С 6 Н 4 -R. Общая формула гомологического ряда бензола С n Н 2n _ 6 (n > 6). Для названия ароматических углеводородов широко используются тривиальные названия (толуол, ксилол, кумол и т. п.). Систематические названия строят из названия углеводородного радикала (приставка) и слова «бензол» (корень): С 6 Н 5 -CH 3 (метилбензол), С 6 Н 5 -С 2 Н 5 (этилбензол). Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Для дизамещен-ных бензолов R-С 6 Н 4 -R используется также и другой способ построения названий, при котором положение заместителей указывают перед тривиальным названием соединения приставками: орто– (o -) – заместители соседних атомов углерода кольца (1,2-); мета– (м -) – заместители через один атом углерода (1,3-); пара– (п -) – заместители на противоположных сторонах кольца (1,4-).

Виды изомерии (структурная): 1) положения заместителей для ди-, три– и тетра-замещенных бензолов (например, о-, м- и п -ксилолы); 2) углеродного скелета в боковой цепи, содержащей не менее 3 атомов углерода; 3) заместителей (R), начиная с R=С 2 Н 5 .
Способы получения ароматических углеводородов1. С 6 Н 12 >Pt, 300 °C > С 6 Н 6 + ЗН 2 (дегидрирование циклоалканов)
2. н- С 6 Н 14 >Cr 2 O 3 , 300 °C > С 6 Н 6 + 4Н 2 (дегидроциклизация алканов)
3. ЗС 2 Н 2 >С, 600 °C > С 6 Н 6 (циклотримеризация ацетилена, реакция Зелинского)
Химические свойства ароматических углеводородовПо химическим свойствам арены отличаются от предельных и непредельных углеводородов. Для аренов наиболее характерны реакции, идущие с сохранением ароматической системы, а именно реакции замещения атомов водорода, связанных с циклом. Другие реакции (присоединение, окисление), в которых участвуют делокали-зованные С-С связи бензольного кольца и нарушается его ароматичность, идут с трудом.
1. C 6 H 6 + Cl 2 >AlCl 3 > C 6 H 5 Cl + HCl (галогенирование)
2. C 6 H 6 + HNO 3 >H 2 SO 4 > C 6 H 5 -NO 2 + H 2 O (нитрование)

3. С 6 Н 6 >H 2 SO 4 > С 6 Н 5 -SO 3 H + H 2 O (сульфирование)
4. С 6 Н 6 + RCl >AlCl 3 > С 6 Н 5 -R + HCl (алкилирование)
5. (ацилирование)

6. С 6 Н 6 + ЗН 2 >t, Ni > С 6 Н 12 циклогексан (присоединение водорода)
7. (1,2,3,4,5,6-гексахлороциклогексан, присоединение хлора)

8. С 6 Н 5 -CH 3 + [О] > С 6 Н 5 -COOH кипячение с раствором КMnO 4 (окисление алкилбензолов)
7. Галогеноуглеводороды
Галогеноуглеводородами называются производные углеводородов, в которых один или несколько атомов водорода заменены на атомы галогена.
Способы получения галогеноуглеводородов1. CH 2 =CH 2 + HBr > CH 3 -CH 2 Br (гидрогалогенирование ненасыщенных углеводородов)
CH?CH + HCl > CH 2 =CHCl
2. CH 3 CH 2 OH + РCl 5 > CH 3 CH 2 Cl + POCl 3 + HCl (получение из спиртов)
CH 3 CH 2 OH + HCl > CH 3 CH 2 Cl + Н 2 O (в присутствии ZnCl 2 , t°C )
3. а) CH 4 + Cl 2 >hv> CH 3 Cl + HCl (галогенирование углеводородов)
 Химические свойства галогеноуглево-дородов
Химические свойства галогеноуглево-дородов
Наибольшее значение для соединений этого класса имеют реакции замещения и отщепления.
1. CH 3 CH 2 Br + NaOH (водн. р-р) > CH 3 CH 2 OH + NaBr (образование спиртов)
2. CH 3 CH 2 Br + NaCN > CH 3 CH 2 CN + NaBr (образование нитрилов)
3. CH 3 CH 2 Br + NH 3 > + Br --HBr - CH 3 CH 2 NH 2 (образование аминов)
4. CH 3 CH 2 Br + NaNO 2 > CH 3 CH 2 NO 2 + NaBr (образование нитросоединений)
5. CH 3 Br + 2Na + CH 3 Br > CH 3 -CH 3 + 2NaBr (реакция Вюрца)
6. CH 3 Br + Mg > CH 3 MgBr (образование магнийорганических соединений, реактив Гриньяра)
7. (дегидрогалогенирование)

Спиртами называются производные углеводородов, в молекулах которых содержится одна или несколько гидроксильных групп (-OH), связанных с насыщенными атомами углерода. Группа -OH (гидроксильная, оксигруппа) является в молекуле спирта функциональной группой. Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы. Нумерация ведется от ближайшего к OH-группе конца цепи.
По числу гидроксильных групп спирты подразделяются на одноатомные (одна группа -OH), многоатомные (две и более групп -OH). Одноатомные спирты: метанол CH 3 OH, этанол С 2 Н 5 OH; двухатомный спирт: этилен-гликоль (этандиол-1,2) HO-CH 2 -CH 2 -OH; трехатомный спирт: глицерин (пропантриол-1,2,3) HO-CH 2 -CH(OH)-CH 2 -OH. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты первичные R-CH 2 -OH, вторичные R 2 CH-OH, третичные R 3 C-OH.
По строению радикалов, связанных с атомом кислорода, спирты подразделяются на предельные, или алканолы (CH 3 CH 2 -OH), непредельные, или алкенолы (CH 2 =CH-CH 2 -OH), ароматические (С 6 Н 5 CH 2 -OH).
Виды изомерии (структурная изомерия): 1) изомерия положения OH-группы (начиная с С 3); 2) углеродного скелета (начиная с С 4); 3) межклассовая изомерия с простыми эфирами (например, этиловый спирт CH 3 CH 2 OH и диметиловый эфир CH 3 -О-CH 3). Следствием полярности связи О-Н и наличия неподеленных пар электронов на атоме кислорода является способность спиртов к образованию водородных связей.
Способы получения спиртов1. CH 2 =CH 2 + Н 2 O/Н + > CH 3 -CH 2 OH (гидратация алкенов)
2. CH 3 -CHO + Н 2 >t, Ni > С 2 Н 5 OH (восстановление альдегидов и кетонов)
3. C 2 H 5 Br + NaOH (водн.) > С 2 Н 5 OH + NaBr (гидролиз галогенопроизводных)
ClCH 2 -CH 2 Cl + 2NaOH (водн.) > HOCH 2 -CH 2 OH + 2NaCl
4. CO + 2Н 2 >ZnO, CuO, 250 °C, 7 МПа > CH 3 OH (получение метанола, промышленность)
5. С 6 Н 12 O 6 >дрожжи > 2С 2 Н 5 OH + 2CO 2 (брожение моноз)
6. 3CH 2 =CH 2 + 2KMnO 4 + 4Н 2 O > 3CH 2 OH-CH 2 OH - этиленгиликоль + 2KOH + 2MnO 2 (окисление в мягких условиях)
7. а) CH 2 =CH-CH 3 + O 2 > CH 2 =CH-CHO + Н 2 O
б) CH 2 =CH-CHO + Н 2 > CH 2 =CH-CH 2 OH
в) CH 2 =CH-CH 2 OH + Н 2 O 2 > HOCH 2 -CH(OH)-CH 2 OH (получение глицерина)
Химические свойства спиртовХимические свойства спиртов связаны с наличием в их молекулу группы -OH. Для спиртов характерны два типа реакций: разрыв связи С-О и связи О-Н.
1. 2С 2 Н 5 OH + 2Na > Н 2 + 2C 2 H 5 ONa (образование алкоголятов металлов Na, К, Mg, Al)
2. а) С 2 Н 5 OH + NaOH ? (в водном растворе не идет)
б) CH 2 OH-CH 2 OH + 2NaOH > NaOCH 2 -CH 2 ONa + 2Н 2 O
в) (качественная реакция на многоатомные спирты – образование ярко-синего раствора с гидроксидом меди)

3. а) (образование сложных эфиров)

б) С 2 Н 5 OH + H 2 SO 4 > С 2 Н 5 -О-SO 3 H + Н 2 O (на холоду)

4. а) С 2 Н 5 OH + HBr > С 2 Н 5 Br + Н 2 O
б) С 2 Н 5 OH + РCl 5 > С 2 Н 5 Cl + POCl 3 + HCl
в) С 2 Н 5 OH + SOCl 2 > С 2 Н 5 Cl + SO 2 + HCl (замещение гидроксильной группы на галоген)
5. С 2 Н 5 OH + HOC 2 H 5 >H 2 SO 4 , <140 °C > C 2 H 5 -O-C 2 H 5 + H 2 O (межмолекулярная гидротация)
6. С 2 Н 5 OH >H 2 SO 4 , 170 °C > CH 2 =CH 2 + H 2 O (внутримолекулярная гидротация)
7. а) (дегидрирование, окисление первичных спиртов)

Фенолами называются производные аренов, в которых один или несколько атомов водорода ароматического кольца замещены на гидроксильные группы. По числу гидроксильных групп в ароматическом кольце различают одно– и многоатомные (двух– и трехатомные) фенолы. Для большинства фенолов используются тривиальные названия. Структурная изомерия фенолов связана с различным положением гидроксильных групп.
 Способы получения фенолов
Способы получения фенолов
1. С 6 Н 5 Cl + NaOH(p, 340°C) > С 6 Н 5 OH + NaCl (щелочной гидролиз галогеноуглеводородов)
2. (кумольный способ получения)

3. C 6 H 5 SO 3 Na + NaOH (300–350°C) > С 6 Н 5 OH + Na 2 SO 3 (щелочное плавление солей ароматических сульфоновых кислот)
Химические свойства феноловФенолы в большинстве реакций по связи О-Н активнее спиртов, поскольку эта связь более полярна за счет смещения электронной плотности от атома кислорода в сторону бензольного кольца (участие непо-деленной электронной пары атома кислорода в системе л-сопряжения). Кислотность фенолов значительно выше, чем спиртов.
Для фенолов реакции разрыва связи С-О не характерны. Взаимное влияние атомов в молекуле фенола проявляется не только в особенностях поведения гидроксигруппы, но и в большей реакционной способности бензольного ядра.

Гидроксильная группа повышает электронную плотность в бензольном кольце, особенно в орто– и пара- положениях (+М-эффект OH-группы). Для обнаружения фенолов используется качественная реакция с хлоридом железа(III). Одноатомные фенолы дают устойчивое сине-фиолетовое окрашивание, что связано с образованием комплексных соединений железа.
1. 2С 6 Н 5 OH + 2Na > 2C 6 H 5 ONa + Н 2 (так же, как и этанол)
2. С 6 Н 5 OH + NaOH > C 6 H 5 ONa + H 2 O (в отличие от этанола)
C 6 H 5 ONa + Н 2 O + CO 2 > С 6 Н 5 OH + NaHCO 3 (фенол более слабая кислота, чем угольная)

Фенолы не образуют сложные эфиры в реакциях с кислотами. Для этого используются более реакционноспособные производные кислот (ангидриды, хлорангидриды).
4. С 6 Н 5 OH + CH 3 CH 2 OH >NaOH > С 6 Н 5 OCH 2 CH 3 + NaBr (О-алкилирование)

(взаимодействие с бромной водой, качественная реакция)
6.(нитрование разб. HNO 3 , при нитрировании конц. HNO 3 образуется 2,4,6-тринитрофенол)

7. n C 6 H 5 OH + n CH 2 O > n H 2 O + (-C 6 H 3 OH-CH 2 -) n (поликонденсация, получение фенолформальдегидных смол)
10. Альдегиды и кетоны
Альдегидами называются соединения, в которых карбонильная группа
соединена с углеводородным радикалом и атомом водорода, а кетонами – карбонильные соединения с двумя углеводородными радикалами.

Систематические названия альдегидов строят по названию соответствующего углеводорода с добавлением суффикса –аль . Нумерацию цепи начинают с карбонильного атома углерода. Тривиальные названия производят от тривиальных названий тех кислот, в которые альдегиды превращаются при окислении: Н 2 С=O – метаналь (муравьиный альдегид, формальдегид); CH 3 CH=O – этаналь (уксусный альдегид). Систематические названия кетонов несложного строения производят от названий радикалов с добавлением слова «кетон». В более общем случае название кетона строится по названию соответствующего углеводорода и суффикса –он ; нумерацию цепи начинают от конца цепи, ближайшего к карбонильной группе. Примеры: CH 3 -CO-CH 3 – диметилкетон (пропанон, ацетон). Для альдегидов и кетонов характерна структурная изомерия. Изомерия альдегидов: а) изомерия углеродного скелета, начиная с С 4 ; б) межклассовая изомерия. Изомерия кетонов: а) углеродного скелета (с С 5); б) положения карбонильной группы (с С 5); в) межклассовая изомерия.
Атомы углерода и кислорода в карбонильной группе находятся в состоянии sp 2 - гибридизации. Связь С=O сильно полярна. Электроны кратной связи С=O смещены к электроотрицательному атому кислорода, что приводит к появлению на нем частичного отрицательного заряда, а карбонильный атом углерода приобретает частичный положительный заряд.
Способы получения альдегидов и кетонов1. а) (дегидрирование, окисление первичных спиртов)
б) (дегидрирование, окисление вторичных спиртов)

2. а) CH 3 CH 2 CHCl 2 + 2NaOH >в воде > CH 3 CH 2 CHO + 2NaCl + H 2 O (гидролиз дигалогенопроизводных)
б) CH 3 СCl 2 CH 3 + 2NaOH >в воде > CH 3 COCH 3 + 2NaCl + H 2 O
3. (гидратация алкинов, реакция Кучерова)


4. (окисление этилена до этаналя)

(окисление метана до формальдегида)
CH 4 + O 2 >400–600 °C, NO > H 2 C=O + H 2 O
Химические свойства альдегидов и ке-тоновДля карбонильных соединений характерны реакции различных типов: а) присоединение по карбонильной группе; б) восстановление и окисление; в) конденсация; д) полимеризация.
1. (присоединение циановодородной кислоты, образование гидроксинитрилов)

2. (присоединение гидросулбфита натрия)

3. (восстановление)

4. (образование полуацеталец и ацеталей)


5. (взаимодействие с гидроксоламином, образование оксима ацетальдегида)

6. (образование дигалогенопроизводных)

7. (?-галогенирование в присутствии OH?)

8. (албдольная конденсация)

9. R-CH=O + Ag 2 O >NH 3 > R-COOH + 2Agv (окисление, реакция «серебряного зеркала»)
R-CH=O + 2Cu(OH) 2 > R-COOH + Cu 2 Ov, + 2H 2 O (красный осадок, окисление)
10. (окисление кетонов, жесткие условия)

11. n CH 2 =O > (-CH2-O-) n параформ n = 8-12 (полимеризация)
11. Карбоновые кислоты и их производные
Карбоновыми кислотами называются органические соединения, содержащие одну или несколько карбоксильных групп -COOH, связанных с углеводородным радикалом. По числу карбоксильных групп кислоты подразделяются на: одноосновные (монокарбоновые) CH 3 COOH (уксусная), многоосновные (дикарбоновые, трикарбоновые и т. д.). По характеру углеводородного радикала различают кислоты: предельные (например, CH 3 CH 2 CH 2 COOH); непредельные (CH 2 =CH(-COOH); ароматические (С 6 Н 5 COOH).
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса –овая и слова «кислота»: HCOOH – метановая (муравьиная) кислота, CH 3 COOH – этановая (уксусная) кислота. Для карбоновых кислот характерная структурная изомерия: а) изомерия скелета в углеводородном радикале (начиная с С 4); б) межклассовая изомерия, начиная с С 2 . Возможна цис-транс-изомерия в случае непредельных карбоновых кислот. Электронная плотность?- связи в карбонильной группе смещена в сторону атома кислорода. Вследствие этого у карбонильного углерода создается недостаток электронной плотности, и он притягивает к себе неподеленные пары атома кислорода гидроксильной группы, в результате чего электронная плотность связи О-Н смещается в сторону атома кислорода, водород становится подвижным и приобретает способность отщепляться в виде протона.

В водном растворе карбоновые кислоты диссоциируют на ионы:
R-COOH - R-COО? + Н +
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.
Способы получения карбоновых кислот1. CH 3 -СCl 3 + 3NaOH > CH 3 -COOH + 3NaCl + Н 2 O (гидролиз тригалогенопроизводных)
2. R-CHO + [О] > R-COOH (окисление альдегидов и кетонов)
3. CH 3 -CH=CH 2 + CO + Н 2 O/Н + >Ni, р, t > CH 3 -CH 2 -CH 2 -COOH (оксосинтез)
4. CH 3 C?N + 2Н 2 O/ Н + > CH 3 COOH + NH 4 (гидролиз нитрилов)
5. CO + NaOH > HCOONa; 2HCOONa + H 2 SO 4 > 2HCOOH + Na 2 SO 4 (получение HCOOH)
Химические свойства карбоновых кислот и их производныхКарбоновые кислоты проявляют высокую реакционную способность и вступают в реакции с различными веществами, образуя разнообразные соединения, среди которых большое значение имеют функциональные производные: сложные эфиры, амиды, нитрилы, соли, ангидриды, гало-генангидриды.
1. а) 2CH 3 COOH + Fe > (CH 3 COO) 2 Fe + Н 2 (образование солей)
б) 2CH 3 COOH + MgO > (CH 3 COO) 2 Mg + Н 2 O
в) CH 3 COOH + KOH > CH 3 COОК + Н 2 O
г) CH 3 COOH + NaHCO 3 > CH 3 COONa + CO 2 + Н 2 O
CH 3 COONa + H 2 O - CH 3 COOH + NaOH (соли карбоновых кислот гидролизуются)
2. (образование вложных эфиров)

(омыление вложного эфира)

3. (получение хлорангидридов кислот)

4. (разложение водой)
5. CH 3 -COOH + Cl 2 >hv > Cl-CH 2 -COOH + HCl (галогенирование в?-положение)
6. HO-CH=O + Ag 2 O >NH 3 > 2Ag + Н 2 CO 3 (Н 2 O + CO 2) (особенности HCOOH)
HCOOH >t > CO + Н 2 O
Жиры – сложные эфиры глицерина и высших одноатомных карбоновых кислот. Общее название таких соединений – триглицериды. В состав природных триглицеридов входят остатки насыщенных кислот (пальмитиновой С 15 Н 31 COOH, стеариновой С 17 Н 35 COOH) и ненасыщенных (олеиновой С 17 Н 33 COOH, линолевой С 17 Н 31 COOH). Жиры состоят главным образом из триглицеридов предельных кислот. Растительные жиры – масла (подсолнечное, соевое) – жидкости. В состав триглицеридов масел входят остатки непредельных кислот.

Жирам как сложным эфирам свойственна обратимая реакция гидролиза, катализируемая минеральными кислотами. При участии щелочей гидролиз жиров происходит необратимо. Продуктами в этом случае являются мыла – соли высших карбоновых кислот и щелочных металлов. Натриевые соли – твердые мыла, калиевые – жидкие. Реакция щелочного гидролиза жиров называется также омылением.

Амины – органические производные аммиака, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы. В зависимости от числа углеводородных радикалов различают первичные RNH 2 , вторичные R 2 NH, третичные R 3 N амины. По характеру углеводородного радикала амины подразделяются на алифатические (жирные), ароматические и смешанные (или жирноароматические). Названия аминов в большинстве случаев образуют из названий углеводородных радикалов и суффикса –амин. Например, CH 3 NH 2 – метиламин; CH 3 -CH 2 -NH 2 – этиламин. Если амин содержит различные радикалы, то их перечисляют в алфавитном порядке: CH 3 -CH 2 -NH-CH 3 – ме-тилэтиламин.
Изомерия аминов определяется количеством и строением радикалов, а также положением аминогруппы. Связь N-Н является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи. Третичные амины не образуют ассоциирующих водородных связей. Амины способны к образованию водородных связей с водой. Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается.
Способы получения аминов1. R-NO 2 + 6[Н] > R-NH 2 + 2H 2 O (восстановление нитросоединений)
2. NH 3 + CH 3 I > I? >NH 3 > CH 3 NH 2 + NH 4 I (алкилирование аммиака)
3. а) С 6 Н 5 -NO 2 + 3(NH 4) 2 S > С 6 Н 5 -NH 2 + 3S + 6NH 3 + 2H 2 O (реакция Зинина)
б) С 6 Н 5 -NO 2 + 3Fe + 6HCl > С 6 Н 5 -NH 2 + 3FeCl 2 + 2Н 2 O (восстановление нитросоединений)
в) С 6 Н 5 -NO 2 + ЗН 2 >катализатор, t > C 6 H 5 -NH 2 + 2Н 2 O
4. R-C?N + 4[H] > RCH 2 NH 2 (восстановление нитрилов)
5. ROH + NH 3 >Al 2 O 3 ,350 °C > RNH 2 + 2H 2 O (получение низших алкиламинов С 2 -С 4)
Химические свойства аминовАмины имеют сходное с аммиаком строение и проявляют подобные ему свойства. Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов. Для аминов характерны ярко выраженные основные свойства. Водные растворы алифатических аминов проявляют щелочную реакцию. Алифатические амины – более сильные основания, чем аммиак. Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку не-поделенная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его?-электронами.

На основность аминов влияют различные факторы: электронные эффекты углеводородных радикалов, пространственное экранирование радикалами атома азота, а также способность образующихся ионов к стабилизации за счет сольватации в среде растворителя. В результате донорного эффекта алкильных групп основность алифатических аминов в газовой фазе (без растворителя) растет в ряду: первичные < вторичные < третичные. Основность ароматических аминов зависит также от характера заместителей в бензольном кольце. Электроноакцепторные заместители (-F, -Cl, -NO 2 и т. п.) уменьшают основные свойства ариламина по сравнению с анилином, а электронодонорные (алкил R-, -OCH 3 , -N(CH 3) 2 и др.), напротив, увеличивают.
1. CH 3 -NH 2 + Н 2 O > OH (взаимодействие с водой)
2. (CH 3) 2 NH + HCl > [(CH 3) 2 NH 2 ]Cl хлорид диметиламмония (взаимодействие с кислотами)
[(CH 3) 2 NH 2 ]Cl + NaOH > (CH 3) 2 NH + NaCl + H 2 O (взаимодействие солей аминов со щелочами)

(ацителирование, с третичными аминами не идет)
4. R-NH 2 + CH 3 I > I? >NH 3 > CH 3 NHR + NH 4 I (алкилирование)
5. Взаимодействие с азотистой кислотой: строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различия первичных, вторичных и третичных аминов.
а) R-NH 2 + HNO 2 > R-OH + N 2 + H 2 O (первичные жирные амины)
б) С 6 Н 5 -NH 2 + NaNO 2 + HCl > [С 6 Н 5 -N?N] + Cl? – соль диазония (первичные ароматические амины)
в) R 2 NH + Н-О-N=O > R 2 N-N=O (N-нитрозамин) + Н 2 O (вторичные жирные и ароматические амины)
г) R 3 N + Н-О-N=O > при низкой температуре нет реакции (третичные жирные амины)

(третичные ароматические амины)
Свойства анилина. Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. Бензольное кольцо ослабляет основные свойства аминогруппы по сравнению с алифатическими аминами и аммиаком, но под влиянием аминогруппы бензольное кольцо становится более активным в реакциях замещения по сравнению с бензолом.
C 6 H 5 -NH 2 + HCl > Cl = C 6 H 5 NH 2 HCl
C 6 H 5 NH 2 HCl + NaOH > C 6 H 5 NH 2 + NaCl + H 2 O
C 6 H 5 NH 2 + CH3I >t > + I?

14. Аминокислоты
Аминокислотами называются гетеро-функциональные соединения, молекулы которых содержат одновременно аминогруппу и карбоксильную группу. В зависимости от взаимного расположения амино– и карбоксильной групп аминокислоты подразделяют на?-, ?-, ?– и т. д. По ИЮПАК, для наименования аминокислот группу NH 2 - называют приставкой амино-, указывая цифрой номер углеродного атома, с которым она связана, а затем следует название соответствующей кислоты.
 2-аминопропановая кислота (?-аминопропановая, ?-аланин)
2-аминопропановая кислота (?-аминопропановая, ?-аланин)
 3-аминопропановая кислота (?-аминопропановая, ?-аланин)
3-аминопропановая кислота (?-аминопропановая, ?-аланин)
 6-аминогексановая кислота (?-аминокапроновая)
6-аминогексановая кислота (?-аминокапроновая)
По характеру углеводородного радикала различают алифатические (жирные) и ароматические аминокислоты. Изомерия аминокислот зависит от строения углеродного скелета, положения аминогруппы по отношению к карбоксильной группе. Для аминокислот характерна еще оптическая изомерия.
Способы получения аминокислот1. (аммонолиз галогенокислот)

2. CH 2 =CH-COOH + NH 3 > H 2 N-CH 2 -CH 2 -COOH (присоединение аммиака к?, ?-непредельным кислотам)

(действие HCN и NH 3 на альдегиды или кетоны)
4. Гидролиз белков под влиянием ферментов, кислот или щелочей.
5. Микробиологический синтез.
Химические свойства аминокислотАминокислоты проявляют свойства оснований за счет аминогруппы и свойства кислот за счет карбоксильной группы, т. е. являются амфотерными соединениями. В кристаллическом состоянии и в среде, близкой к нейтральной, аминокислоты существуют в виде внутренней соли – дипо-лярного иона, называемого также цвиттер-ион H 3 N + -CH 2 -COO?.
1. H 2 N-CH 2 -COOH + HCl > Cl? (образование солей по аминогруппе)
2. H 2 N-CH 2 -COOH + NaOH > H 2 N-CH 2 -COO?Na + + H 2 O (образование солей)

(образование сложного эфира)

(ацилирование)
5. + NH 3 -CH 2 -COO? + 3CH 3 I >-HI > (CH 3) 3 N + -CH 2 -COO? – бетаин аминоуксусной кислоты
(алкилирование)

(взаимодействие с азотистой кислотой)
7. n H 2 N-(CH 2) 5 -COOH > (-HN-(CH 2) 5 -CO-) n + n H 2 O (получение капрона)
15. Углеводы. Моносахариды. Олигосахариды. Полисахариды
Углеводы (сахара) – органические соединения, имеющие сходное строение и свойства, состав большинства которых отражает формула С х (Н 2 O) y , где х, у ? 3.
Классификация:

Моносахариды не гидролизуются с образованием более простых углеводов. Олиго-и полисахариды расщепляются при кислом гидролизе до моносахаридов. Общеизвестные представители: глюкоза (виноградный сахар) С 6 Н 12 O 6 , сахароза (тростниковый, свекловичный сахар) С 12 Н 22 О 11 , крахмал и целлюлоза [С 6 Н 10 О 5 ] n .
Способы получения1. mCO 2 + nН 2 O >hv, хлорофилл > C m (H 2 O) n (углеводы)+ mO 2 (получение при фотосинтезе)
углеводы: С 6 Н 12 O 6 + 6O 2 > 6CO 2 + 6Н 2 O + 2920 кДж
(метаболизм: глюкоза окисляется с выделением большого количества энергии в живом организме в процессе метаболизма)
2. 6nCO 2 + 5nН 2 O >hv, хлорофилл > (С 6 Н 10 О 5) n + 6nO 2 (получение крахмала или целлюлозы)
Химические свойстваМоносахриды. Все монозы в кристаллическом состоянии имеют циклическое строение (?– или?-). При растворении в воде циклический полуацеталь разрушается, превращаясь в линейную (оксо-) форму.


Химические свойства моносахаридов обусловлены наличием в молекуле функциональных групп трех видов (карбонила, спиртовых гидроксилов и гликозидного (полуацетального) гидроксила).
1. С 5 Н 11 O 5 -CHO (глюкоза) + Ag 2 O >NH 3 > CH 2 OH-(CHOH) 4 -COOH (глюконовая кислота) + 2Ag (окисление)
2. С 5 Н 11 O 5 -CHO (глюкоза) + [Н] > CH 2 OH-(CHOH) 4 -CH 2 OH(сорбит)(восстановление)

(моноалкилирование)

(полиалкилирование)

5. Важнейшим свойством моносахаридов является их ферментативное брожение, т. е. распад молекул на осколки под действием различных ферментов. Брожению подвергаются в основном гексозы в присутствии ферментов, выделяемых дрожжевыми грибками, бактериями или плесневыми грибками. В зависимости от природы действующего фермента различают реакции следующих видов:
а) С 6 Н 12 O 6 > 2С 2 Н 5 OH + 2CO 2 (спиртовое брожение);
б) С 6 Н 12 O 6 > 2CH 3 -CH(OH)-COOH (молочнокислое брожение);
в) С 6 Н 12 O 6 > С 3 Н 7 COOH + 2CO 2 + 2Н 2 O (маслянокислое брожение);
г) С 6 Н 12 O 6 + O 2 > HOOC-CH 2 -С(OH)(COOH)-CH 2 -COOH + 2Н 2 O (лимоннокислое брожение);
д) 2С 6 Н 12 O 6 > С 4 Н 9 OH + CH 3 -CO-CH 3 + 5CO 2 + 4Н 2 (ацетон-бутанольное брожение).
Дисахариды. Дисахариды – углеводы, молекулы которых состоят из двух остатков моносахаридов, соединенных друг с другом за счет взаимодействия гидроксильных групп (двух полуацетальных или одной полуацетальной и одной спиртовой). Отсутствие или наличие гликозидного (полуацетального) гидроксила отражается на свойствах дисахаридов. Биозы делятся на две группы: восстанавливающие и невосстанавливающие. Восстанавливающие биозы способны проявлять свойства восстановителей и при взаимодействии с аммиачным раствором серебра окисляться до соответствующих кислот, содержат в своей структуре гликозидный гидроксил, связь между монозами – гликозид-гликозная. Схема образования восстанавливающих биоз на примере мальтозы:

Для дисахаридов характерна реакция гидролиза, в результате которой образуются две молекулы моносахаридов:

Примером наиболее распространенных в природе дисахаридов является сахароза (свекловичный или тростниковый сахар). Молекула сахарозы состоит из остатков?-D-глюкопиранозы и?-D-фруктофуранозы, соединенных друг с другом за счет взаимодействия полуацетальных (гликозидных) гидроксилов. Биозы этого типа не проявляют восстанавливающих свойств, так как не содержат в своей структуре гликозидного гидроксила, связь между монозами – гликозид-гликозидная. Подобные дисахариды называют невосстанавливающими, т. е. не способными окисляться.
Схема образования сахарозы:

Инверсия сахарозы. При кислом гидролизе (+)сахарозы или при действии инвертазы образуются равные количества D(+)глюкозы и D(-)фруктозы. Гидролиз сопровождается изменением знака удельного угла вращения [?] с положительного на отрицательный, поэтому процесс называют инверсией, а смесь D(+)глюкозы и D(-)фруктозы – инвертным сахаром.

Полисахариды (полиозы). Полисахариды – природные высокомолекулярные углеводы, макромолекулы которых состоят из остатков моносахаридов. Основные представители: крахмал и целлюлоза, которые построены из остатков одного моносахарида – D-глюкозы. Крахмал и целлюлоза имеют одинаковую молекулярную формулу: (С 6 Н 10 О 5) n , но различные свойства. Это объясняется особенностями их пространственного строения. Крахмал состоит из остатков?-D-глюкозы, а целлюлоза – из?-D-глюкозы. Крахмал – резервный полисахарид растений, накапливается в виде зерен в клетках семян, луковиц, листьев, стеблей, представляет собой белое аморфное вещество, нерастворимое в холодной воде. Крахмал – смесь амилозы и амилопектина, которые построены из остатков?-D-глюкопиранозы.
Амилоза – линейный полисахарид, связь между остатками D-глюкозы 1?-4. Форма цепи – спиралевидная, один виток спирали содержит 6 остатков D-глюкозы. Содержание амилозы в крахмале – 15–25 %.
 амилоза
амилоза
 амилопектин
амилопектин
Амилопектин – разветвленный полисахарид, связи между остатками D-глюкозы – 1?-4 и 1?-6. Содержание амилопектина в крахмале 75–85 %.
1. Образование простых и сложных эфиров (аналогично биозам).
2. Качественная реакция – окрашивание при добавлении иода: для амилозы – в синий цвет, для амилопектина – в красный цвет.
3. Кислый гидролиз крахмала: крахмал > декстрины > мальтоза > ?-D-глюкоза.
Целлюлоза. Структурный полисахарид растений, построен из остатков?-D-глюкопиранозы, характер соединения 1?-4. Содержание целлюлозы, например, в хлопчатнике – 90–99 %, в лиственных породах – 40–50 %. Этот биополимер обладает большой механической прочностью и выполняет роль опорного материала растений, образуя стенки растительных клеток.
Характеристика химических свойств1. Кислый гидролиз (осахаривание): целлюлоза > целлобиоза > ?-D-глюкоза.
2. Образование сложных эфиров


Из растворов ацетата целлюлозы в ацетоне изготавливают ацетатное волокно.

Нитроцеллюлоза взрывоопасна, составляет основу бездымного пороха. Пироксилин – смесь ди– и тринитратов целлюлозы – используют для изготовления целлулоида, коллодия, фотопленок, лаков.